Analyse statistique
Nous avons effectué des tests χ2 et des tests exacts de Fisher, et examiné les médianes et les IQR pour vérifier l'équivalence dans les distributions d'âge, de sexe, de type d'assurance et d'EMM de référence entre les groupes. Étant donné que l'EMM de référence a été associé à des changements dans les dosages d'opioïdes, des analyses ont été menées pour les 3 strates d'EMM : moins de 50, de 50 à moins de 90, et 90 ou plus.
Pour ajuster les variables de confusion selon le point de référence, une méthode basée sur le score de propension (SP) a été utilisée pour estimer les effets de poids de traitement moyen. Pour chaque strate, les effets de poids de traitement moyen ont été utilisés selon le modèle de séries chronologiques interrompues contrôlé par score de propension pour évaluer les différences dans les tendances des EMM entre les groupes exposés et non exposés pendant la période de pré-intervention. Les mêmes modèles ont également permis d'obtenir le lien entre la durée de la prise de cannabis médical et les doses d'opioïdes après le début de la prise de cannabis médical. Tous les résultats ont été fixés à un niveau de signification statistique de P bilatéral = 0,05. Les analyses statistiques ont été effectuées à l'aide du logiciel SAS version 9.4 (SAS Institute). Les données ont été analysées de novembre 2021 à février 2022.

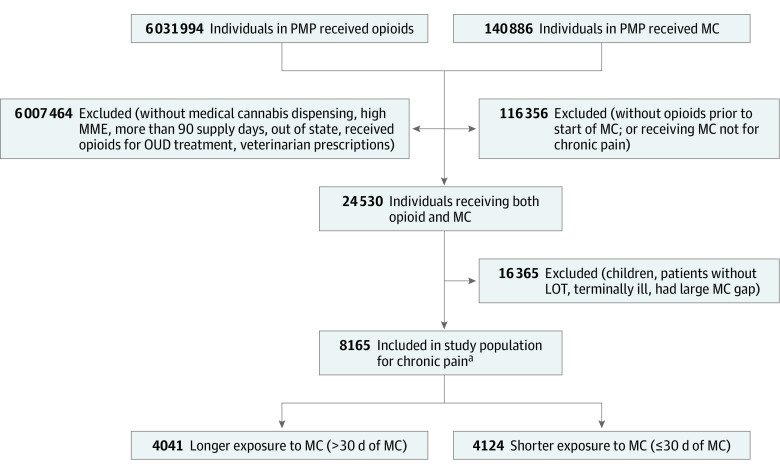
Figure 1 : la population étudiée. Entre 2017 et 2019, 8165 patients recevant des opioïdes à longue durée d'action ont également reçu du cannabis médical pour leurs douleurs chroniques. Parmi eux, 4041 patients (âge médian [IQR], 57 [47-65] ans ; 2376 [58,8%] femmes) ont reçu du cannabis médical pendant une durée plus longue, et 4124 patients (âge médian [IQR], 54 [44-62] ans ; 2370 [57,5%] femmes) ont reçu du cannabis médical pendant une durée plus courte.
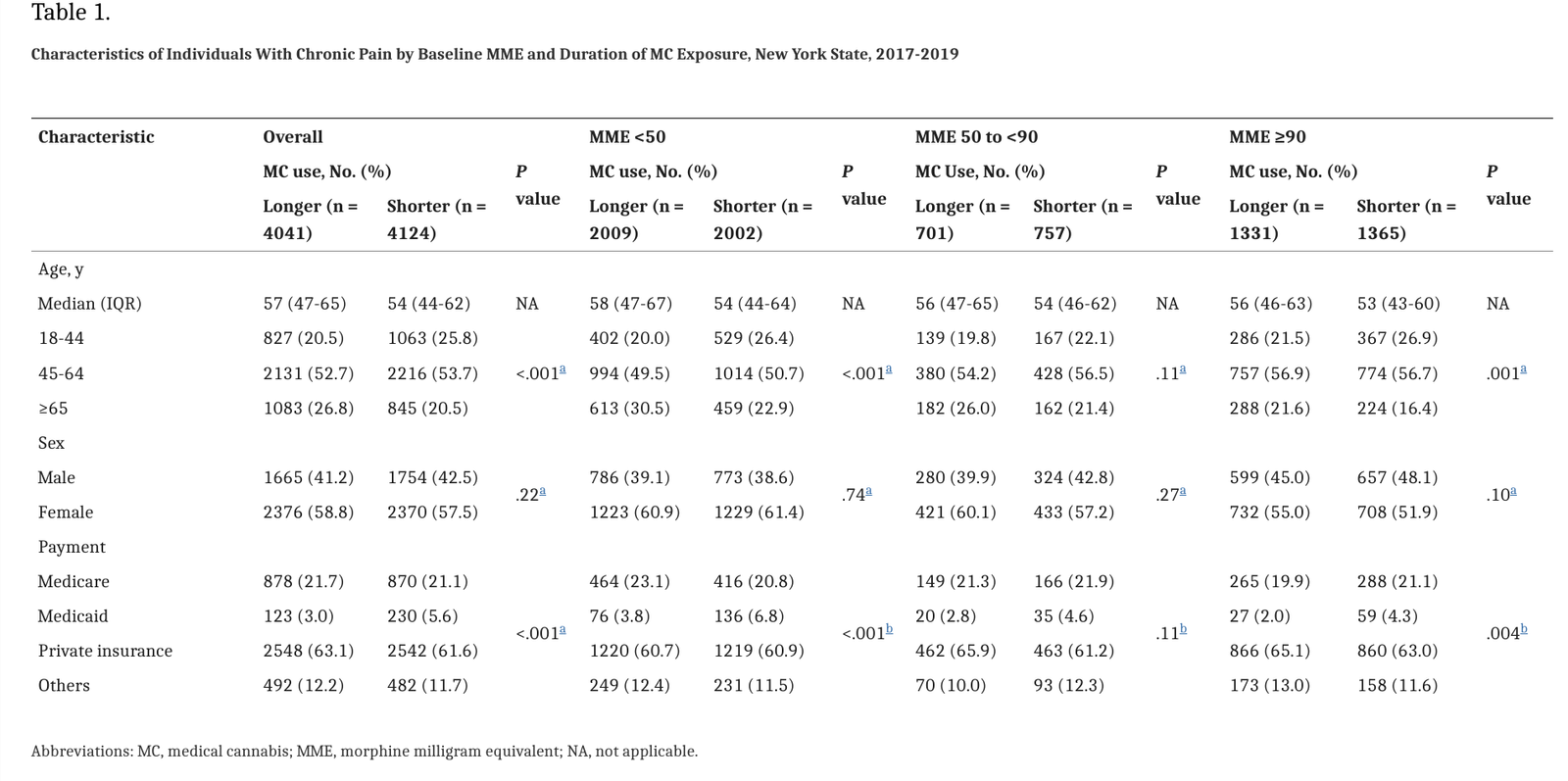
Le tableau 1 ci-dessous fournit des données sur l'âge, le sexe, l'assurance et l'EMM (équivalent milligrammes morphine) de tous les participants en début d'étude, l'EMM servant de base pour les classifier. Environ la moitié de ces patients se sont vu prescrire moins de 50 EMM, un tiers se sont vu prescrire 90 EMM ou plus, et le reste recevait de 50 à moins de 90 EMM au début de l'étude. Dans l'ensemble, il y avait des différences statistiquement significatives dans les distributions d'âge et de source de paiement entre les groupes exposés et non exposés. (Tableau 1) Le groupe exposé comprenait plus de patients âgés de 65 ans et plus (1 083 patients [26,8 %] contre 845 patients [20,5%]) et moins de patients âgés de 18 à 44 ans (827 patients [20,5%] contre 1 063 patients [25,8%]) que le groupe non exposé. Plus de la moitié des patients de chaque groupe avaient une assurance privée (2 548 patients [63,1%] dans le groupe exposé et 2 542 patients [61,6%] dans le groupe non exposé). Le groupe exposé comptait moins de patients bénéficiant de l'assurance Medicaid (l'équivalent de notre CMU) (123 patients [3,0%] contre 230 patients [5,6%]) que le groupe non exposé. L'EMM quotidien en début d'étude était similaire pour les groupes exposé et non exposé (Tableau 1). Il n'y avait pas d'information manquante pour ces variables.

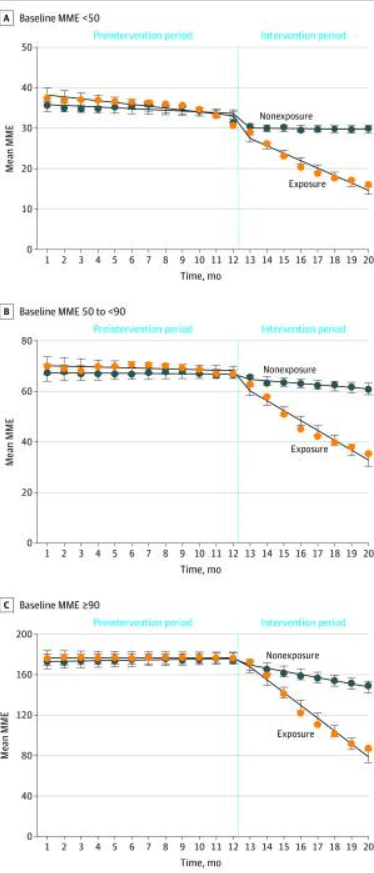
Figure 2 : tendances moyennes quotidiennes observées et estimées par le modèle pour une période de 30 jours d'EMM pour les groupes exposés et non-exposés, classées selon l'EMM de base. Les EMM moyens pour le groupe exposé étaient généralement plus élevés que ceux du groupe non-exposé dans l'ensemble des strates. Dans les deux strates avec des EMM plus faibles (Figure 2A et B), les deux groupes ont montré de légères tendances à la baisse avant même de commencer à prendre du cannabis médical. Cependant, des tendances statistiquement significatives ont été observées uniquement dans la strate la plus faible d'EMM : une réduction mensuelle d'EMM de -0,20 (IC 95%, -0,31 à -0,09) a été observée dans le groupe non-exposé, tandis que le groupe exposé a connu une réduction de l'EMM de -0,27 (-0,43 à -0,11) (Tableau 2). Avant le début de l'étude, aucune variation significative de l'EMM n'a été observée dans les deux groupes pour les patients ayant une dose initiale de 50 EMM ou plus.


Au début de l'étude, la moyenne observée (écart type) des EMM pour les groupes exposés et non exposés était de 30,7 (17,3) vs 31,4 (18,5) dans la strate la plus basse, 66,9 (19,9) vs 66,6 (17,9) pour la strate moyenne, et 176,2 (106,9) vs 174,0 (106,1) pour la strate la plus élevée (Figure 2). Après le début de l'étude, des réductions plus importantes de l'EMM quotidien ont été observées dans le groupe exposé par rapport au groupe non exposé (Figure 2).
Dans la strate des EMM les plus faibles (figure 2A), l'EMM quotidien moyen à la fin de l'étude pour le groupe exposé était de 16,0 (22,2), soit une réduction de 48 % par rapport à l'EMM de base de 30,7, contre 30,0 (25,4) pour le groupe non exposé, soit une réduction de 4 % par rapport à l'EMM de base de 31,4. Les analyses ajustées ont révélé que le groupe exposé présentait une réduction mensuelle de l'EMM plus importante que le groupe non exposé, avec une différence de -1,52 (IC 95 %, -1,67 à -1,37) EMM (tableau 2). Il en résulte une réduction nette totale d'EMM de -14,53 (IC 95 %, -17,45 à -11,61) sur 8 mois pour le groupe exposé par rapport aux modifications de l'EMM dans le groupe non exposé.
Parmi les patients dont l'EMM initial était compris entre 50 et moins de 90 (figure 2B), l'EMM quotidien moyen (écart type) à la fin de l'étude était de 35,4 (37,6) pour le groupe exposé (soit une réduction de 47 %), contre 60,8 (35,7) pour le groupe non exposé (soit une réduction de 9 %). L'analyse ajustée a montré une différence significative de -3,24 (IC 95 %, -3,61 à -2,87) dans la réduction mensuelle des EMM entre le groupe exposé et le groupe non exposé (tableau 2). Après 8 mois, une réduction totale de l'EMM de -29,49 (IC 95 %, -35,94 à -23,04) a été observée dans le groupe exposé par rapport au groupe non exposé.
Pour les adultes dont l'EMM initial était égal ou supérieur à 90 à la fin de l'étude, l'EMM quotidien moyen (écart type) était de 87,2 (106,6) pour le groupe exposé (soit une réduction de 51 % par rapport à l'EMM initial de 176,2) contre 149,0 (114,0) pour le groupe non exposé (soit une réduction de 14 % par rapport à l'EMM initial de 174) (figure 2C). Les analyses ajustées ont montré une différence de réduction mensuelle de l'EMM de -9,33 (Intervalle de confiance de 95 %, -9,89 à -8,77) entre les deux groupes. Une réduction nette importante de -69,81 (IC à 95 %, -87,09 à -52,53) a été observée pour le groupe exposé au cours de l'intervention de 8 mois.
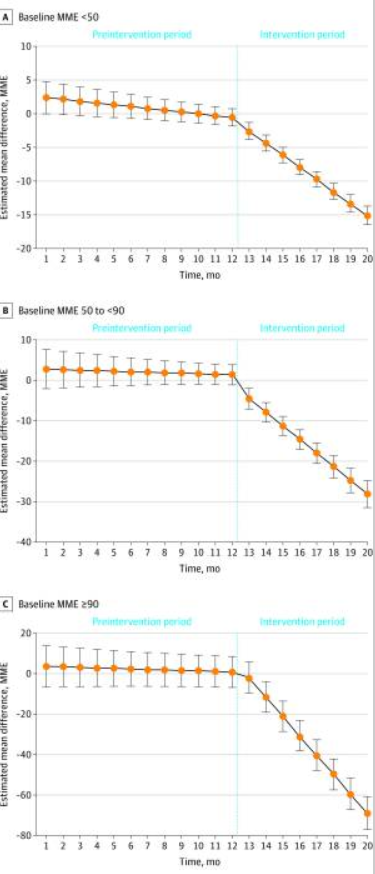
Des analyses supplémentaires portant sur les différences quotidiennes d'EMM entre les groupes exposés et non exposés n'ont pas révélé de différences statistiquement significatives avant le début de l'étude. Après le début de l'étude, les différences entre les groupes se sont considérablement accrues au fil du temps (figure 3).

Différences estimées pour la moyenne mensuelle de l'équivalent en milligrammes de morphine (EMM) entre les groupes exposés et non exposés en fonction de l'EMM de référence, État de New York, 2017-2019.
Le groupe exposé était composé de patients ayant reçu du cannabis médical pendant plus de 30 jours, et le groupe non exposé était composé de patients ayant reçu du cannabis médical pendant 30 jours ou moins. Les estimations sont basées sur les modèles de séries temporelles interrompues pondérées par le score de propension, ajustées en fonction de l'âge, du sexe et de la source de paiement. Les moustaches indiquent que les intervalles de confiance s'élèvent à 95%.
Discussion
Cette étude de cohorte de patients de l'État de New York recevant une thérapie à base d'opioïdes sur le long terme a révélé que le fait de recevoir du cannabis médical pour des douleurs chroniques pendant une plus longue durée était associé à des réductions significatives des doses d'opioïdes. Des réductions plus importantes ont été observées chez les patients recevant des doses d'opioïdes plus élevées au départ. Parmi les patients dont le dosage initial était inférieur à 50 mg, une réduction mensuelle significative des doses quotidiennes d'opioïdes (-1,52 mg) a été observée chez les adultes bénéficiant d'une prescription de cannabis médical de longue durée par rapport à ceux bénéficiant d'une prescription de cannabis médical de plus courte durée. Cette réduction était 5,6 fois plus importante que la différence entre les groupes avant la prise de MC (-0,27 MME). Plus la dose d'opioïdes des patients était élevée au départ, plus la réduction mensuelle était importante : -3,24 EMM pour les patients recevant de 50 à moins de 90 EMM et -9,33 EMM pour les patients recevant 90 EMM ou plus. Ces réductions étaient 24,9 fois plus importantes dans la strate moyenne et 37,3 fois plus importantes dans la strate la plus élevée que les différences observées avant la prise de cannabis médical.
Parmi les patients ayant reçu du cannabis médical sur une plus longue durée, la dose quotidienne moyenne pour le groupe ayant une dose de base de 90 EMM ou plus a été réduite à moins de 90 EMM (87,2), et la dose moyenne parmi ceux de la strate de 50 à moins de 90 EMM a été réduite à moins de 50 EMM (35,4 MME). Si elles peuvent être reproduites, ces réductions pourraient avoir un impact sur la morbidité et la mortalité futures de cette population.
Au cours du mois suivant le début de l'intervention, les deux groupes recevant du cannabis médical se sont vu prescrire des doses d'opioïdes plus faibles ; les patients du groupe non exposé ont arrêté de prendre du cannabis médical après 30 jours, tandis que les patients du groupe exposé ont continué à en prendre. Cela pourrait expliquer les réductions plus importantes et plus nettes de l'EMM chez les adultes ayant bénéficié d'une prescription de cannabis médical plus longue. Même après avoir pris en compte les réductions chez les adultes ayant reçu du cannabis médical moins longtemps, les réductions nettes totales estimées pour les patients ayant reçu du cannabis médical plus longtemps au cours de l'intervention de 8 mois étaient de 14,53 CM (pour cannabis médical) dans la strate de base la plus basse, de 29,49 dans la strate de base moyenne et de 69,81 dans la strate de base la plus élevée. Parmi les patients ayant reçu du cannabis médical plus longtemps, l'EMM quotidien a été réduit de 47% à 51% des doses de base après l'étude de 8 mois. Les adultes recevant du cannabis médical depuis moins longtemps ont réduit leurs doses de base de seulement 4% à 14%.
Nous ne disposions pas d'informations permettant de déterminer si les patients ont choisi le cannabis médical comme traitement d'appoint pour diminuer les doses d'opioïdes, ou en réponse à la pression exercée par le clinicien pour diminuer les doses d'opioïdes. Cependant, aucune réglementation n'interdit l'utilisation simultanée d'opioïdes et de cannabis médical. L'importance clinique des réductions d'opioïdes associées au cannabis médical est illustrée par les lignes directrices des Centers for Disease Control and Prevention sur la prescription d'opioïdes pour la douleur chronique, qui soulignent l'augmentation du risque d'overdose à mesure que l'EMM prescrit augmente. Les cliniciens qui s'occupent des patients recevant une thérapie à base d'opioïdes sur le long terme doivent discuter du rôle que le cannabis médical peut jouer dans la gestion de la douleur, et s'informer sur les risques et les avantages. Lorsque des patients souhaitent commencer à prendre du cannabis médical et que leur médecin actuel ne peut ou ne veut pas les certifier, ils doivent être orientés vers un praticien qui sera en mesure de le faire.
Les patients souffrant de douleurs chroniques et bénéficiant de la couverture sociale Medicaid reçoivent des doses plus élevées d'opioïdes que les personnes assurées dans le secteur privé, et sont plus susceptibles de bénéficier de thérapies à base d'opioïdes sur le long terme. Peu de patients dans la population étudiée étaient assurés par Medicaid, et parmi ceux qui ont commencé à prendre du cannabis médical, ils sont nombreux à avoir arrêté rapidement. Le caractère inabordable d'un médicament qui peut réduire le besoin d'opioïdes pour le traitement de la douleur, et peut-être que le risque de troubles liés à l'utilisation d'opioïdes et d'overdose constituent une inégalité en matière de santé qui mérite d'être étudiée plus en détail.
Il est prouvé que le cannabis médical a des effets secondaires : parmi les plus courants figurent les effets psychoactifs, les vertiges et la sécheresse de la bouche. D'autres préoccupations incluent le trouble de l'utilisation de cannabis et les symptômes de sevrage. La réglementation de l'État de New York autorise les dispensaires à vendre du cannabis médical contenant du THC ; toutefois, le THC est limité à une faible dose de 10 mg. Par conséquent, le risque d'effets indésirables et de troubles liés à la consommation de cannabis est faible si les patients utilisent le cannabis médical conformément aux instructions. Une étude précédente sur le cannabis médical a montré que si 37,3 % des patients ont connu au moins un effet indésirable, la plupart étaient bénins et moins de 2 % des patients ont dû ajuster la dose ou arrêter le traitement, ce qui suggère que le cannabis médical est bien plus sûr que les opioïdes. Cependant, la prudence reste de mise pour certifier les patients présentant certaines comorbidités, notamment en cas de maladie coronarienne, d'arythmie, d'antécédents de psychose, ou encore chez les patientes enceintes.
Cette étude présente plusieurs points forts. À notre connaissance, il s'agit de la première étude basée sur la population avec un échantillon de grande taille qui évalue l'association entre la durée de la prise de cannabis médical et la réduction des doses quotidiennes d'opioïdes. La durée de la prise de cannabis médical a été utilisée pour mesurer rigoureusement l'état d'exposition et les opioïdes concomitants. L'utilisation des méthodes du modèle CITS sur les données des patients nous a permis d'évaluer les tendances avant le début de l'étude et de générer les différences nettes de l'EMM quotidien entre les groupes exposés et non exposés après le début de l'intervention. Même si tous les facteurs de confusion n'ont pas été contrôlés, il est très peu probable que les réductions plus importantes et plus nettes juste après le début de l'intervention, et les réductions continues dans les groupes exposés soient dues à des facteurs autres que le fait de recevoir du cannabis médical plus longtemps chez les patients à partir des 3 niveaux de base de l'EMM. Les études futures devraient examiner plus en détail les effets spécifiques de différents types ou combinaisons de produits et de dosages de cannabis médical en rapport avec les dosages d'opioïdes prescrits.
Limites
Cette étude présente certaines limites. Tout d'abord, notre étude ne comportait pas d'évaluation des doses de cannabis médical, du type de produit ou du rapport THC/BCD parmi les produits reçus afin de déterminer s'il y avait une différence en fonction de ces variables. Cependant, nous avons pu confirmer la réception de cannabis médical et nous avons utilisé la durée d'approvisionnement en cannabis médical pour mesurer l'exposition. Il s'agit d'une étude observationnelle, qui pourrait être sujette à un biais de sélection. Cependant, étant donné que les patients des deux groupes, exposés et non exposés, ont activement cherché et initialement reçu des soins médicaux, cela ne peut qu'avoir un impact sur la généralisation des résultats. Les informations relatives à la couleur de peau et à l'origine ethnique ainsi que les informations cliniques, telles que les comorbidités ou les causes de la douleur chronique, étaient insuffisantes. Cependant, les groupes exposés et non exposés dans chaque strate étaient comparables en ce qui concerne plusieurs facteurs de confusion connus. En outre, les modèles CITS basés sur le score de propension (utilisé pour contrôler les facteurs de confusion et le biais de sélection) sont des techniques avancées pour améliorer la validité et la précision, de sorte que les résultats peuvent être comparables aux résultats des essais cliniques randomisés. Nous ne savons pas si les patients qui ont cessé d'utiliser des opioïdes prescrits sont passés aux opioïdes illicites, ou si ceux qui ont cessé de prendre du cannabis médical sont passés au marché non réglementé. En outre, nous ne disposons pas de données sur le niveau de douleur des patients ; nous n'avons donc pas pu évaluer l'amélioration de la prise en charge de la douleur.
Conclusions
Cette étude de cohorte a montré que le fait de recevoir du cannabis médical pendant plus longtemps était associé à des réductions des doses d'opioïdes. Les réductions étaient plus importantes chez les personnes à qui l'on avait prescrit des doses plus élevées d'opioïdes au départ. Ces résultats apportent des preuves solides aux cliniciens concernant les avantages potentiels du cannabis médical dans la réduction du fardeau des opioïdes pour les patients recevant une thérapie à base d'opioïdes sur le long terme, et éventuellement dans la réduction du risque d'overdose. D'autres recherche sur le cannabis médical en tant que traitement alternatif ou complémentaire aux opioïdes pour traiter la douleur chronique et la crise des opioïdes restent toutefois nécessaires.
Étude d'origine en anglais